Altern, gesundes Altern, Epigenetik, Langlebigkeit
Mechanismen der Alterung
Das Altern ist ein komplexer Prozess, der mit dem Verlust der physiologischen Integrität und einer höheren Sterblichkeit einhergeht. Diese Verschlechterung führt zu einem höheren Risiko für nicht übertragbare Krankheiten wie Krebs, Herz-Kreislauf-Erkrankungen, neurodegenerative Erkrankungen und Diabetes.
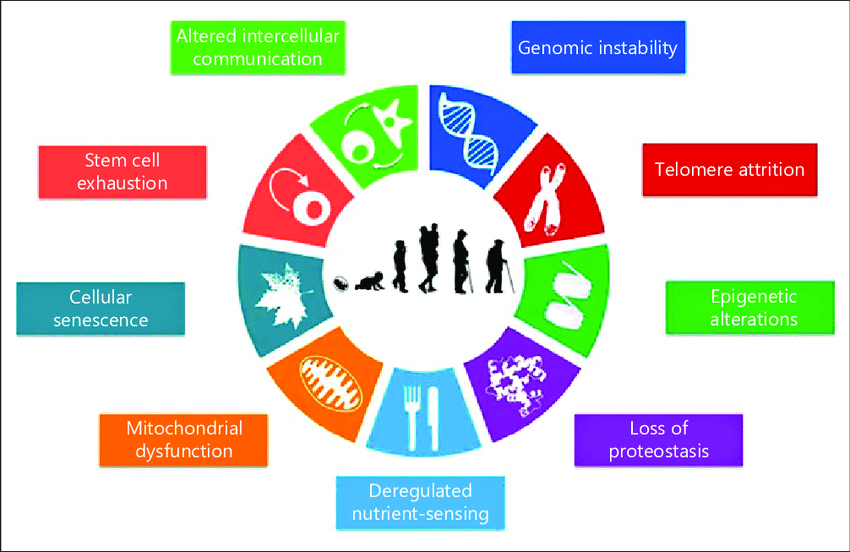
Nach dem derzeitigen Stand der Wissenschaft gibt es neun Hauptmerkmale des Alterns.
Alle diese altersrelevanten Faktoren können durch eine angemessene Ernährung und Lebensweise positiv beeinflusst werden
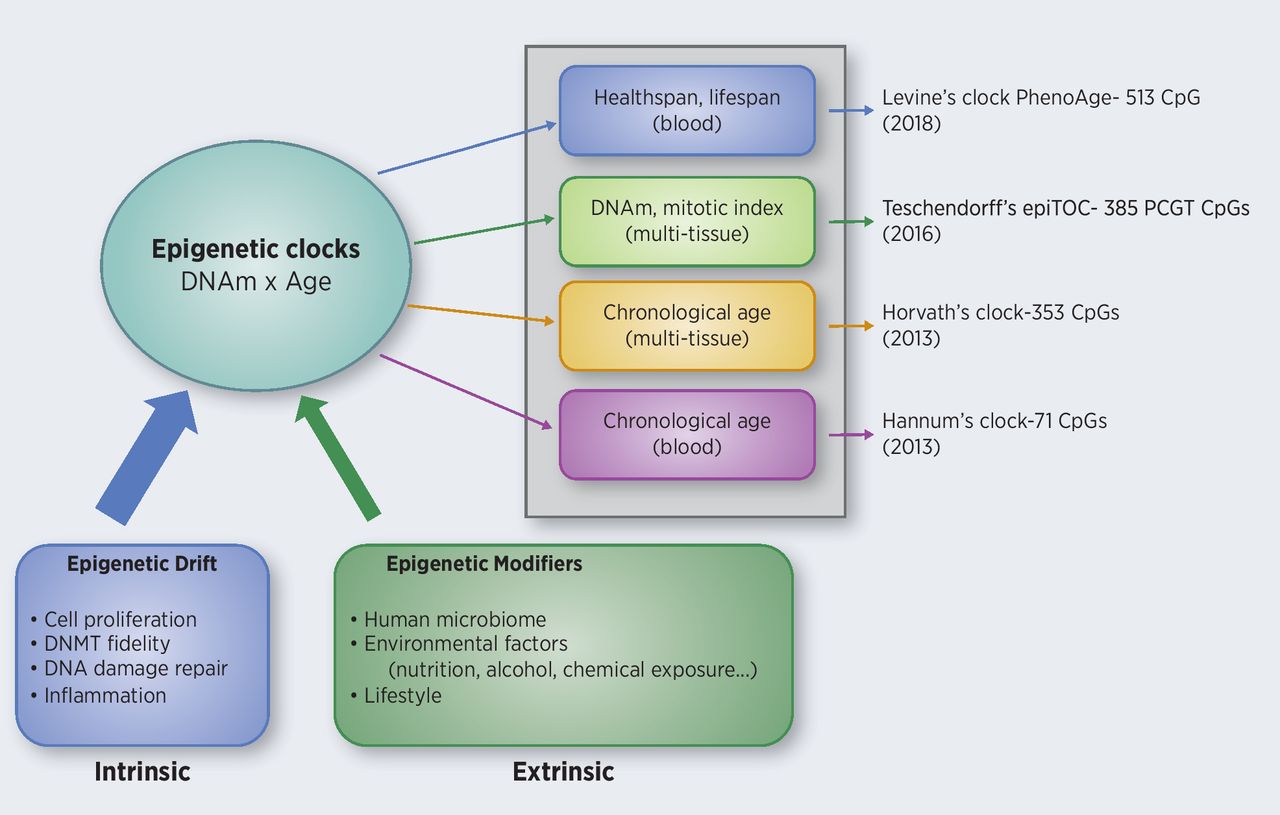
Epigenetische Marker & die biologische Uhr
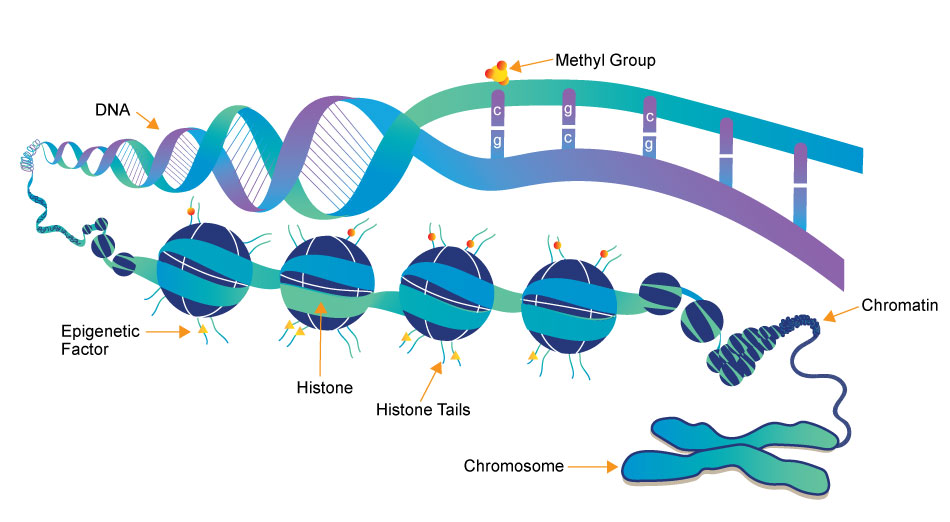
Epigenetische Regulierung ist die sequenzunabhängige Regulierung der DNA durch Signale wie Ernährung, Lebensstil oder sozialen Stress.
Die Methylierung der DNA ist ein Teil der Epigenetik. Wenn Cytosine in regulatorischen Regionen eines Gens durch Methyltransferasen methyliert werden, wird die Transkription dieser Gene in der Regel reduziert.
Globale DNA-Methylierung und Alterung
Eine große Anzahl von CpGs-Methylierungen wird analysiert. Mit zunehmendem Alter wird im Allgemeinen ein Rückgang der globalen DNA-Methylierung beobachtet.
Ortsspezifische DNA-Methylierung und Alterung
Im Gegensatz zur globalen DNA-Methylierung zeigen einige GpGs eine Zunahme der Methylierung mit zunehmendem Alter. Je kleiner die Menge der analysierten CpGs ist, desto mehr fallen ihre spezifischen Beziehungen zum Altern ins Gewicht.ck
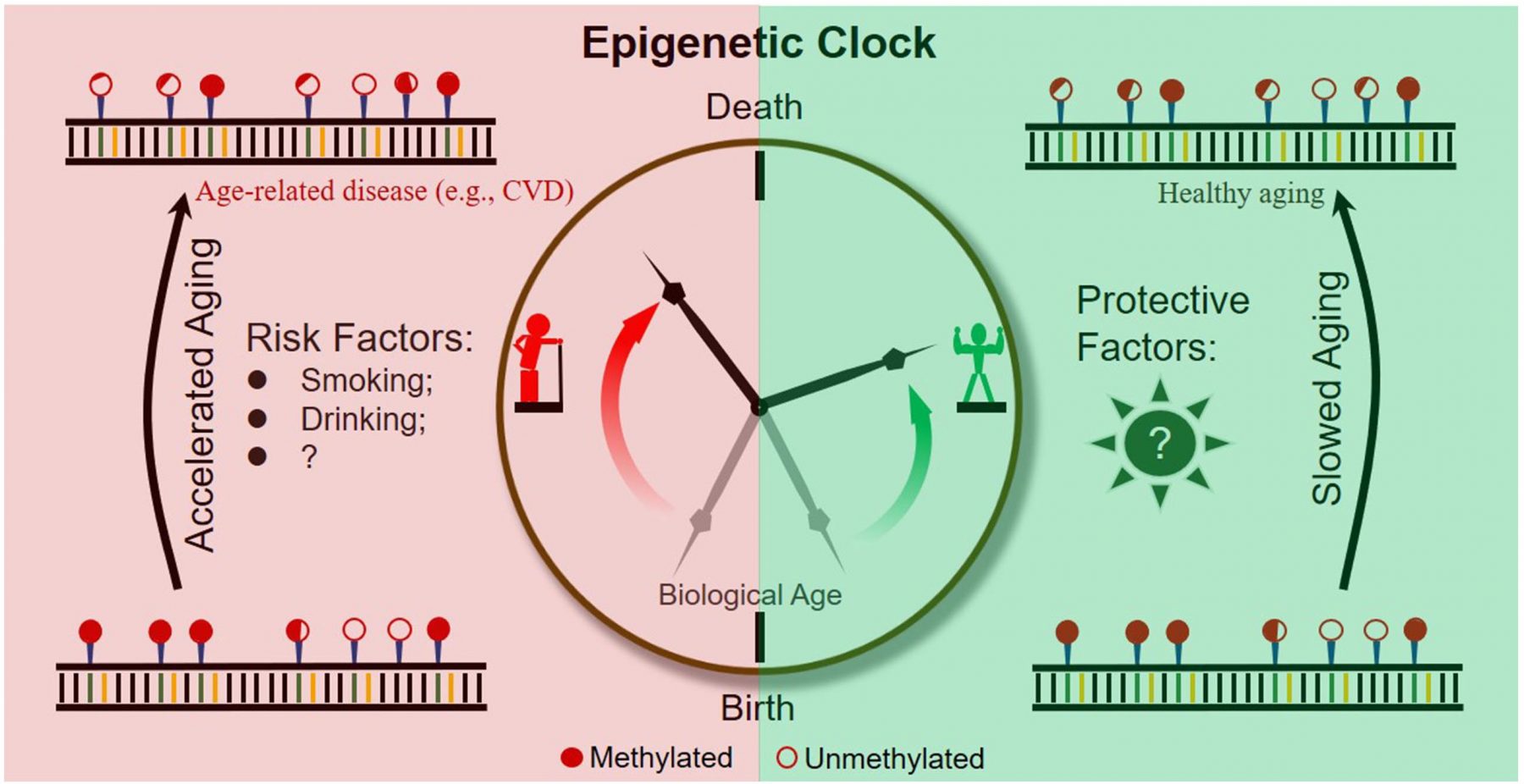
Die Methylierung bestimmter altersbezogener CpGs kann das Alter sehr genau vorhersagen. Im Jahr 2013 gelang es Horvath, einen gewebeübergreifenden Prädiktor für das Alter zu entwickeln, der eine Korrelation von 0,96 zum chronologischen Alter und eine Fehlerspanne von 3,6 Jahren aufweist. Die 353 beobachteten CpGs weisen mit fortschreitendem Alter die gleichen Methylierungsmuster auf, unabhängig vom Gewebe. Das bedeutet, dass die epigenetische Uhr in langsam proliferierenden Gehirnzellen und in schnell proliferierenden Blutzellen gleich tickt.
Warum sind Menschen älter als ihr chronologisches Alter?
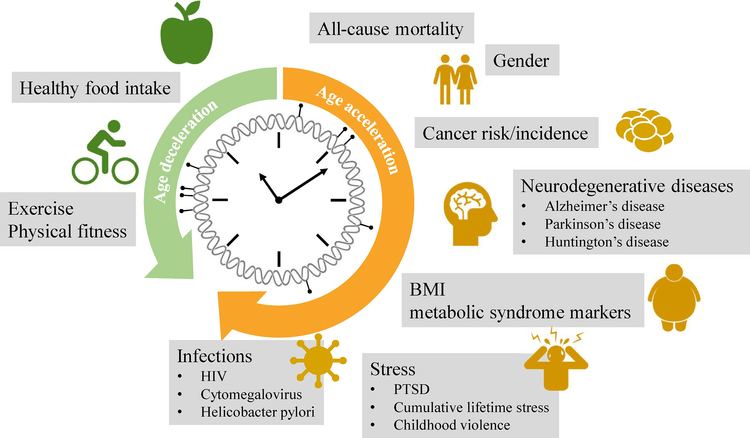
Es gibt mehrere Gründe für eine verstärkte epigenetische Alterung. Lebensstil und Ernährung sind Aspekte, die Menschen jünger oder älter machen können. Fettleibigkeit wird mit einem höheren Alter in Verbindung gebracht. Faktoren wie der Verzehr von Fisch, Obst und Gemüse sowie Bildung und Sport können zu geringeren Anzeichen des Alterns führen. Das bedeutet, dass eine ausreichende Zufuhr von Nährstoffen eine vorzeitige Alterung verhindern kann und hilft, gesund zu bleiben. Andere Gründe können Virusinfektionen, neurologische Erkrankungen, Krebs und ein hormonelles Ungleichgewicht sein.
Epigenetisches Alter und Mortalität
Das epigenetische Alter korreliert mit dem Mortalitätsrisiko. Eine Altersbeschleunigung von 5 Jahren bedeutet einen Anstieg des Sterblichkeitsrisikos um 16 %.
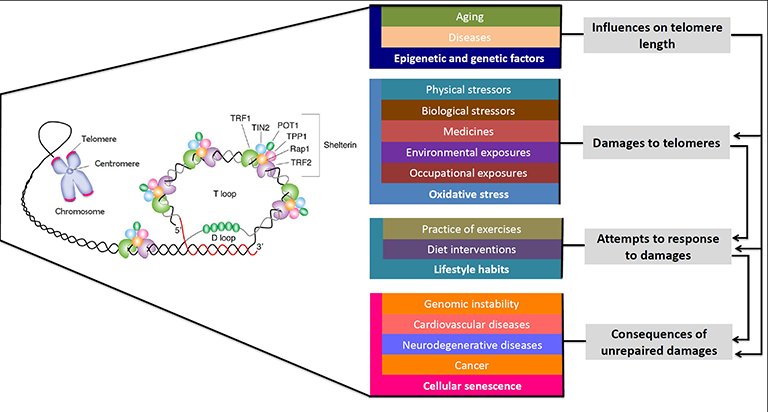
Telomere
Chromosomen enthalten die genetische Information eines Organismus und sind aus DNA-Molekülen aufgebaut. Telomere bestehen aus sich wiederholenden 5′-TTAGGG-3′-Sequenzen und befinden sich an den Enden der Chromosomen. Diese spezialisierten Strukturen, die aus DNA und Proteinen bestehen, bieten Schutz und Stabilität. Sie können mit den Enden von Schnürsenkeln verglichen werden. Extrem verkürzte Telomere können zu einer Instabilität des Genoms und in der Folge zu Krankheiten führen.
Bei jeder Zellteilung verkürzen sich die Telomere, bis die DNA nicht mehr repliziert werden kann. Dies führt zum Zustand der Seneszenz (keine Zellteilung mehr) oder zum programmierten Zelltod (Apoptose). Das bedeutet, dass die Teilung normaler Körperzellen begrenzt ist.
Seneszente Zellen (SC) tragen zum Alterungsprozess und zu altersbedingten Krankheiten bei, da sie proinflammatorische Signale aussenden, die den gesamten Organismus beeinträchtigen können.
Viele Studien haben gezeigt, dass Menschen mit einer guten pflanzlichen Ernährung und einem aktiven Lebensstil längere Telomere haben als Kontrollgruppen. Phytochemikalien wie Polyphenole (z.B. aus grünem Tee) können ebenfalls dazu beitragen, die Telomere länger zu erhalten.
Die Telomerlänge und die Telomeraseaktivität werden durch epigenetische Mechanismen unter Beteiligung von h TERT streng reguliert.
Apoptose, Autophagie und Seneszenz
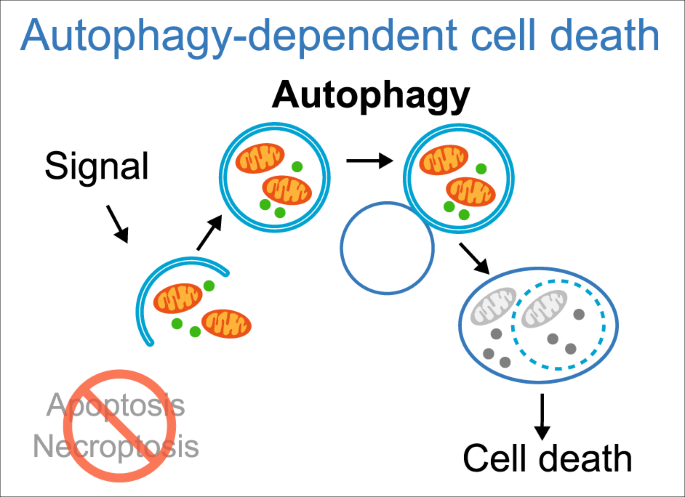
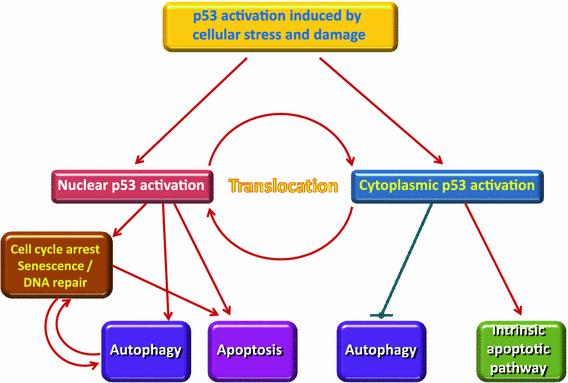
Die Autophagie ist ein Aufräumprozess, der die Beseitigung aggregierter oder fehlgefalteter Proteine und das Recycling beschädigter Zellbestandteile bewirkt und dabei eine wichtige Rolle spielt. Die Autophagie wird durch Fasten und CR hochreguliert und hat eine schützende Funktion gegen Genominstabilität und Nekrose. Im Großen und Ganzen spielt sie eine wichtige Rolle bei der Vorbeugung vieler Krankheiten wie Infektionen, Diabetes, Krebs, Autoimmunkrankheiten und anderen,
Apoptose ist ein geordneter Prozess, bei dem der Inhalt der Zelle in kleine Membranpakete verpackt wird, die dann von Immunzellen „entsorgt“ werden. Apoptose beseitigt Zellen während der Entwicklung, eliminiert potenziell krebserregende und virusinfizierte Zellen und hält das Gleichgewicht im Körper aufrecht.
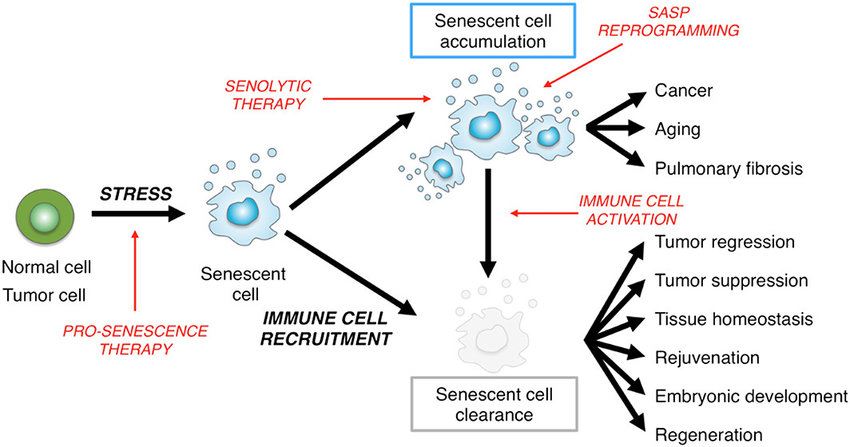
Zelluläre Seneszenz ist ein Phänomen, bei dem normale Zellen aufhören, sich zu teilen. In den 1960er Jahren fanden Leonard Hayflick und Paul Moorhead heraus, dass normale menschliche fötale Fibroblasten in Kultur ein Maximum von etwa 50 Zellpopulationsverdopplungen erreichen, bevor sie seneszent werden. Seneszenz kann durch Stressfaktoren wie Telomerverkürzung, DNA-Schäden, onkogene Mutationen, metabolische und mitochondriale Dysfunktion und Entzündungen ausgelöst werden. Die Belastung durch seneszente Zellen nimmt in verschiedenen Geweben mit dem Altern zu, an pathologischen Stellen bei verschiedenen chronischen Krankheiten und nach Strahlen- oder Chemotherapie.
Seneszente Zellen (SC) spielen eine große Rolle imAlterungsprozess und bei altersbedingten körperlichen Funktionsstörungen. SC unterscheiden sich stark von gesunden Zellen. Charakteristisch sind die Expression verschiedener Gene, die Einstellung der Replikation und die vermehrte Produktion von entzündungsfördernden Signalen. Solche Signalstoffe sind z.B. entzündungsfördernde Zytokine, Chemokine und bilden zusammen den so genannten Seneszenz-assoziierten sekretorischen Phänotyp (SASP). Die durch SC ausgelöste Entzündung kann zu Gewebedysfunktion führen und auch gesunde Zellen altern lassen.
Seneszenzzellen verfügen über mehrere Wege, um der Apoptose zu entgehen. An dieser Stelle kommen Senolytika ins Spiel. Xu und Kollegen fanden heraus, dass eine Mischung aus Dasatinib und Quercetin (Flavonoid) selektiv die SC eliminiert und so die körperliche Dysfunktion und das Überleben im späteren Leben von Mäusen verbessert. Jetzt werden eine Reihe von Arzneimitteln und funktionellen Nahrungsmitteln/Zusatzstoffen und insbesondere Kalorienrestriktion/Fasten auf ihre Wirkung zur Reduzierung von Seneszenzzellen im Gewebe untersucht. Dies hätte weitreichende Auswirkungen auf Langlebigkeit, Gesundheit und wirtschaftliche Aspekte.
Stoffwechselwege im Alter, Fasten, IGF, Insulinsignalisierung und SIRT
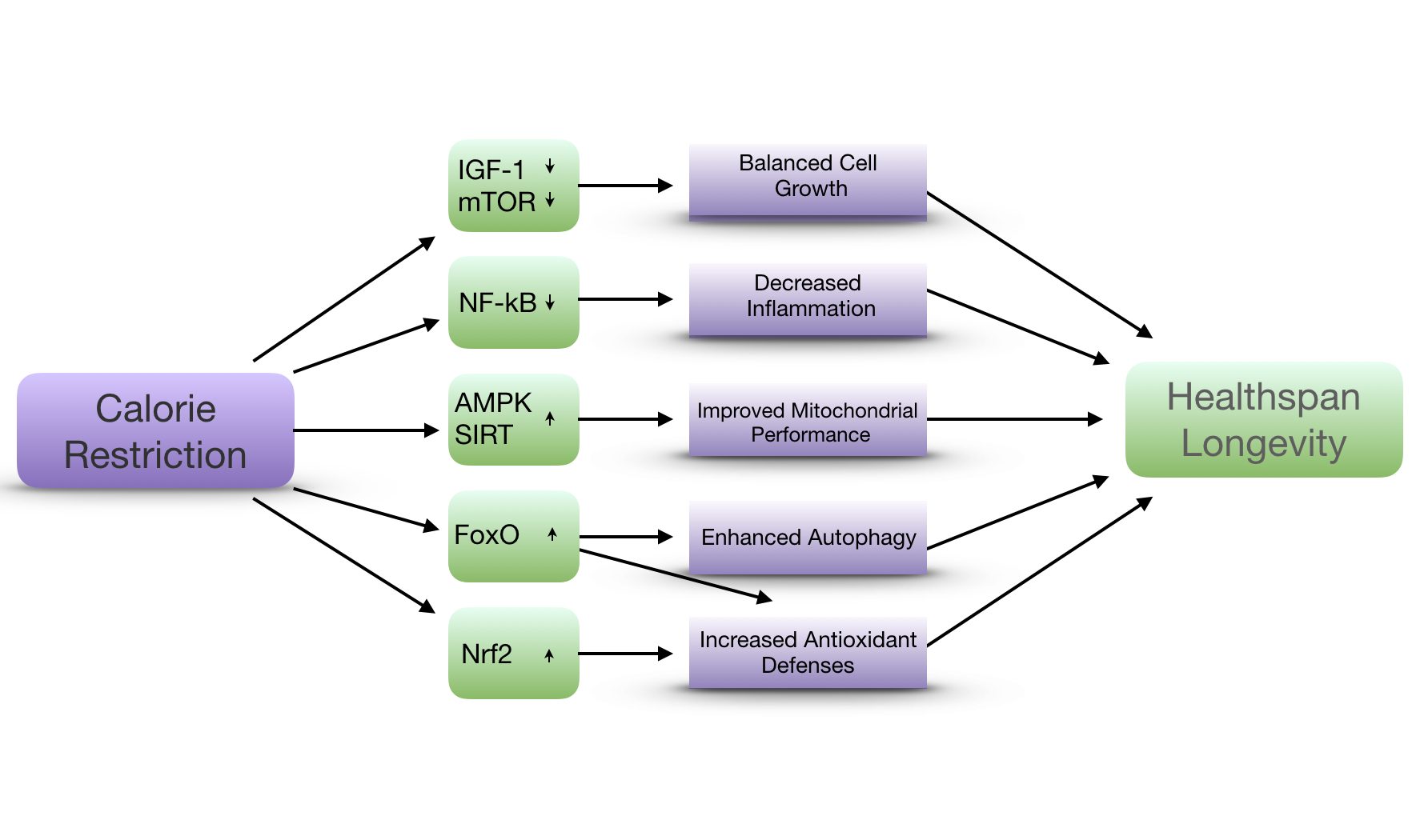
Bei der Nahrungsaufnahme werden Wachstumshormone (GH) freigesetzt, die den Insulin- und IGF-1-Signalweg aktivieren, um die Zellen mit Informationen über den Glukosestatus zu versorgen, so dass sie entsprechend reagieren können. Eine ständige Aktivierung dieses Stoffwechselweges kann für den Organismus schädlich sein. Es hat sich gezeigt, dass Säugetiere mit einem genetischen Polymorphismus, der die GH- und IGF-1-Signalisierung reduziert, eine höhere Lebenserwartung haben und besser in der Lage sind, Stressbedingungen zu widerstehen.
Fasten führt zu einer Verringerung der anabolen Signalwege und induziert katabole Signalwege (z.B. AMPK, FOXO und Sirtuine). SIRT 1 zum Beispiel zeigt positive Auswirkungen, indem es den Stoffwechsel umschaltet und endogene Fettsäuren zur Hauptenergiequelle macht. AMPK wird aktiviert, wenn es ein niedriges AMP-Niveau feststellt, und blockiert mTOR, was zu einer Stimulierung der Autophagie und einer Interaktion mit SIRT1 zu einer positiven Rückkopplungsschleife führt.molecules.stem cell functions
Während hohe ROS-Werte (radikale Sauerstoffspezies) die Alterung beschleunigen, scheinen niedrige ROS-Werte notwendig zu sein, um den Zustand der Ruhe und die Fähigkeit zur Selbsterneuerung aufrechtzuerhalten. Fasten kann ROS durch einen ketogenen Stoffwechsel verringern.